Détails
MIDORI Green Direct est une alternative sûre au bromure d’éthidium (EtBr) pour la visualisation d’ADNdb, d’’ADNsb et d’ARN en gels d’agarose. Contrairement à la plupart des autres colorants non composés d’EtBr, MIDORI Green Direct est simplement ajouté à vos échantillons. Le colorant de charge est déjà inclus. Il n’est donc pas nécessaire d’ajouter un colorant de charge à la matrice du gel ou au tampon de migration.
- Coloration directe de l’ADN/ARN
- Non toxique, non carcinogène
- Alternative sûre au bromure d’éthidium
- Colorant de charge inclus
- Bruit de fond très faible
Obtenez le meilleur ratio signal/bruit
La coloration directe de l’ADN plutôt que celle du gel permet d’éliminer le signal du bruit de fond et offre donc un signal parfait (Fig. 1). MIDORIGreen Direct a été développé pour fonctionner avec des illuminateurs à LED bleue, mais il peut également être utilisé avec un transilluminateur classique à UV.

Fig. 1 : Gauche : MIDORI Green Direct détecté par lumière LED Bleu/Vert. Droite : Bromure d’éthidium détecté par lumière UV.
De meilleurs résultats pour les expériences suivantes
L’isolement de l’ADN à partir du gel d’agarose permet de réaliser des expériences en ultérieures avec l’ADN. Cependant, beaucoup de colorants tels que le bromure d’éthidium ou le SYBR™ Green sont de puissants inhibiteurs enzymatiques dû à leurs propriétés d’intercalants. Les colorants MIDORI Green se lient au squelette ADN, permettant une meilleure efficacité lors des expériences suivantes, comme le clonage (Fig. 2), le séquençage, les PCR etc…
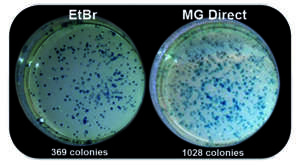
Fig. 2 : Meilleure efficacité de clonage avec le MIDORI Green Direct. Augmentation du nombre de colonies E. coli transformées avec MIDORI Green Direct en comparaison avec le bromure d’éthidium.
Télécharger notre Note d’utilisation (Application Note) pour plus d’informations
Sécurité prouvée
Le colorant MIDORI Green Direct est non cancérigène et moins mutagène que le bromure d’éthidium. De plus, il ne pénètre pas les gants en latex et les membranes cellulaires.
MIDORI Green Direct est classifié comme non dangereux pour la vie aquatique (Official California Code of Regulations, Title 22). De ce fait, de petites quantités peuvent être relâchées dans la nature sans danger.
- Ames-Test
- Acute Oral Toxicity Test
- Mouse Bone Marrow Micronucleus Test
- Chromosome Aberration Test
- Latex and Nitrile Gloves Penetration
Télécharger ici notre rapport de sûreté du MIDORI Green Direct.
Colorant de charge
Le colorant MIDORIGreen Direct est présenté sous la forme d’un colorant de charge 10X et doit être ajouté uniquement aux échantillons. Il n’est pas nécessaire de l’ajouter au gel ou au tampon de charge.
Échantillon gratuit
hbspt.forms.create({
region: “na1”,
portalId: “8262428”,
formId: “e78f1d3a-4281-4c7f-89a6-0923fa36b0ec”
});
Utilisations
Coloration des produits de digestion
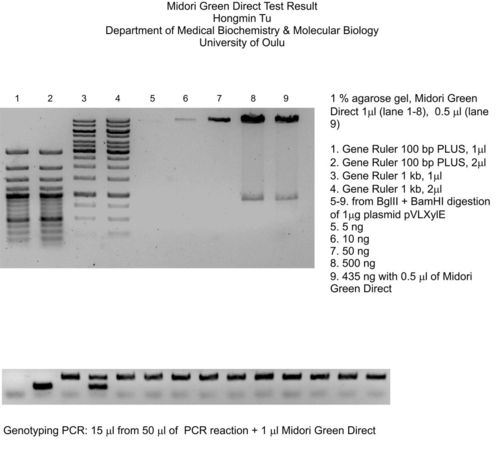
Coloration d’échelles d’ADN à différentes concentrations

Fig. 2 : Gel d’agarose 1 % – les échantillons sont directement colorés avec MIDORI GREEN DIRECT
FAQ
Pourquoi MGA et MGD ne peuvent-ils pas être utilisés de la même manière ?
Les structures chimiques sont complètement différentes. Nous avons testé l’utilisation du Midori Green Direct (MGD) en tant que MGA et inversement, et nous ne pouvons pas recommander de les utiliser de la même manière. Lorsque vous essayez d’utiliser le MGD en tant que MGA, vous avez besoin de beaucoup de MGD et d’échelle ADN pour obtenir des bandes visibles. Les échantillons de faible concentration pourraient donc ne être détectés. Le MGD a été conçu pour être ajouté à l’échantillon et est beaucoup moins concentré que le MGA. Il n’est donc pas rentable d’utiliser le MGD à la place du MGA car vous aurez besoin d’une quantité 10 fois supérieure dans le gel pour pouvoir observer des bandes. Lorsque vous essayez d’utiliser le MGA en tant que MGD, cela pose également être problématique car le MGA est trop concentré et migre dans la direction opposée. J’ai essayé de réduire la concentration de MGA, mais dans ce cas vous ne voyez que quelques bandes qui sont très faibles, et ceci quelle que soit la dilution utilisée. En résumé, les deux colorants sont conçus (avec une formule structurelle différente) et optimisés pour différentes utilisations (in-gel et en l’ajoutant dans un échantillon) et il n’est pas recommandé d’essayer de les utiliser autrement.
Quelle est la différence entre le MGA et le MGD, et à quel point ces colorants sont-ils stables ?
La principale différence est que MGA est destiné aux utilisations in-gel et poststaining (donc utilisé comme le bromure d’éthidium) alors que MGD est ajouté directement à l’échantillon. En fonction du système de documentation, nous vous recommandons d’utiliser l’un ou l’autre, mais vous pouvez utiliser les deux pour chaque type d’illuminateur (UV 302, 365 nm, illuminateur à LED Bleue et transilluminateur à LED Bleu/Vert) – seul le rendement peut être augmenté à un niveau optimal. Par exemple, nous recommandons d’utiliser le MGA si l’utilisateur dispose d’un transilluminateur UV, car les résultats obtenus sont fantastiques avec ce colorant. Vous obtenez également une performance vraiment exceptionnelle avec nos instruments à LED Bleu/Vert et le MGD – pas de bruit de fond et un signal intense. Les deux colorants étant stables à température ambiante, leur expédition à température ambiante ne pose pas de problème, mais nous vous recommandons de les stocker à 4 °C.
Est-ce que le MGA et le MGD fonctionnent avec les gels d’agarose et d’acrylamide ?
Nos clients nous ayant fait des retours, il semblerait que le MGD et MGA (poststaining) fonctionnent avec des gels d’acrylamide mais ils ont initialement été conçus pour les gels d’agarose.
Est-il possible d’utiliser Midori Green dans un gel de Polyacrylamide/Urée ?
Cela fonctionne très bien.
Est-ce que le Midori fonctionne avec des gels d’Urée/Formamide ?
Malheureusement cela ne fonctionne pas, à cause du Formamide. Les gels d’urée fonctionnent.
J’utilise la Green Taq de Promega avec le colorant. Le colorant peut-il créer un conflit avec l’utilisation du MGD?
Cela dépend de l’illuminateur que vous utilisez. Il n’y aura pas de problème avec un illuminateur à lumière UV, car le colorant ne sera pas visible mais si vous utilisez l’éclairage à LED Bleu/Vert, il est possible de détecter le colorant du Promega Green Taq. Si vous n’avez pas de chance, il est possible que la bande de l’échantillon soit aussi grosse que la bande du colorant et dans ce cas, la bande du colorant recouvrira celle de l’ADN. Mais en général, il n’y a aucune interaction entre Midori et le colorant Promega. Donc tant que la lumière UV est utilisée ou que la bande d’ADN n’a pas la même taille que la bande de colorant, il ne devrait y avoir aucun problème.
Est-ce que le MGD peut se lier à l’ADN des produits de PCR non purifiés ?
Oui c’est possible.
Seuls les clients connectés peuvent laisser un avis.












Olivia Masseck, Fakultät für Biologie & Biotechnologie, Universität Bochum –
“Midori Green Direct ist sehr gut detektierbar und lässt sich auch wenn nötig mit UV Licht anregen. Gleichzeitig ist es überzeugend einfach in der Anwendung.”
Translation by Nippon Genetics:
“Midori Green Direct is very good detectable and can be excited with UV light if necessary. At the same time it is convincing by the easy handling.”
Utilisateur vérifié